Цариця-вода
 Багато століть люди не знали, що являє собою вода, і як з'явилася вона на планеті. До XIX століття люди не знали, що вода - хімічна сполука. Її вважали звичайним хімічним елементом. Після цього понад сто років усі й усюди вважали, що вода - з'єднання, описуване єдино можливою формулою H2O . Багато століть люди не знали, що являє собою вода, і як з'явилася вона на планеті. До XIX століття люди не знали, що вода - хімічна сполука. Її вважали звичайним хімічним елементом. Після цього понад сто років усі й усюди вважали, що вода - з'єднання, описуване єдино можливою формулою H2O .
У 1932 році світ облетіла сенсація: крім звичайної води, в природі існує ще й важка вода. Сьогодні відомо, що ізотопних різновидів води може бути 135. Склад води, навіть повністю звільнений від мінеральних і органічних домішок, складний і різноманітний. Таке непросте це "найпростіше з'єднання" - вода.
«Тобою насолоджуються не відаючи, що ти таке», - звертався до води Антуан де Сент Екзюпері. Той самий, що написав прекрасну казку про маленького принца.
Ми не можемо прожити без води і декількох днів. Тим часом довгі століття люди не тільки не знали, що вона собою являє, але не знали навіть, скільки її на Землі. І вже зовсім було неясно, як з'явилася вона на планеті. Вода була ще до появи людини: є всі підстави вважати, що життя виникло у водному середовищі.
Як з'явилася вода і скільки її на нашій планеті.
Мільярди років тому в холодній газопиловій хмарі, яка з часом згустилася, ущільнилася і стала Землею, вже містилася вода. Швидше за все, вона була у вигляді крижаного пилу. Це підтверджують дослідження Всесвіту. Встановлено, що вихідні елементи для утворення води - водень і кисень - в нашій Галактиці належать до шести найпоширенішим речовинам космосу.
Скупчення молекул води і гідроксидних радикалів виявлені за межами Сонячної системи. У сузір'ях Кассіопеї і Оріона знайдені хмари, що складаються з молекул води. Розміри хмар колосальні - їх протяжність в 40 разів перевищує відстань від Сонця до Землі. Нерідкі випадки падіння на Землю залишків кометних ядер - "посланців" далеких світів. Найчастіше вони являють собою гігантські брили льоду, замерзлого з метаном, аміаком і мінеральними частинками. З'явившись на поверхні планети складним шляхом, вода не стала інертною, пасивним середовищем. Разом з парами води виділялися не тільки оксиди вуглецю, але і сполуки азоту, фосфору, сірки, які разом з киснем, вуглецем і воднем складають хімічну основу життя. Найбільш сприятливі умови для появи і розвитку життя створилися у водному середовищі. В даний час підрахунок кількості води на Землі виконаний з усією точністю, доступній сучасній науці.
Встановлено, що гідросфера - океани, моря, річки, озера, болота, атмосферна волога - вимірюється значною величиною - 1,385×10^9 км3 води, або 1,4×10^19 т. Три чверті поверхні планети покрито водою.
Якщо розподілити всю воду рівномірно по поверхні земної кулі, середній радіус якої 6370 км, вийде плівка завтовшки менш як 3 км. Не багато води в загальному обсязі планети. Об'єм доступної прісної води обчислюється вже не мільйонами, а тисячами кубічних кілометрів. Найбільше прісної води на земній поверхні накопичено в озерах — 176,4×10^3 км3 Витоки безлічі річок, великих і малих, знаходяться в болотах, які містять 10 300 км3 прісної води. 13000 т води міститься в найближчих до земної поверхні шарах атмосфери. На висоті до 1 км концентрація водяної пари в повітрі в середньому становить 2%.
Ось, мабуть, і вся вода, на яку може реально розраховувати людство тепер і в найближчому майбутньому. Так чи проста вода
"Найпростіше стійке з'єднання водню з киснем", - таке визначення води дає Коротка хімічна енциклопедія. Все вірно, тільки найпростіше в хімії - це далеко не просте.
До XIX століття люди не знали, що вода - хімічна сполука. Її вважали звичайним хімічним елементом. Лише в 1805 році Олександр Гумбольдт і Жозеф Луї Гей Люссак встановили, що вода складається з молекул, кожна з яких містить два атоми водню і один кисню.
Після цього понад сто років усі й усюди вважали, що вода - описуване єдино можливою формулою H2O..
Лише в 1932 році світ облетіла сенсація: крім води звичайної, в природі існує ще й важка вода. У молекулах такої води місце водню займає його важкий ізотоп - дейтерій.
Важку воду відкрили американські фізики Гаральд Юрі і Ельберт Осборн. У 1933 році американець Герберт Льюїс спільно з Річардом Макдональдом вперше виділили її в чистому вигляді.
У невеликих кількостях важка вода постійно і повсюдно присутня в природних водах, зовні абсолютно не відрізняючись від звичайної води. Розрізнити їх можна лише по фізичних характеристиках. В молекулу важкої води входять атоми не легкого водню - протію (1H), а його ізотопи - дейтерію (2D), атом якого на одиницю важче протию, отже, молекулярна вага важкої води на 2 одиниці більше: 20, а не 18. Формула важкої води D2O. Вона на 10% щільніша звичайної, її в'язкість вище на 23%. Вона кипить при 101,42 ° С, а замерзає при +3,8 ° С.
Такі особливості дозволяють зрозуміти нерівномірність вмісту важкої води в тих чи інших природних водах. Наприклад, в замкнутих водоймах її більше, оскільки в порівнянні із звичайною водою вона випаровується менш інтенсивно. Тому важкої води більше в місцевостях з жарким кліматом. Збагачується дейтерієм і поверхня океану на екваторі і в тропіках, тим більше що свою лепту вносять часті атмосферні опади, при утворенні яких йдуть процеси конденсації води з парової фази , а важка вода конденсується швидше, ніж легка, отже, опади збагачені важкою водою. Однак для океанської поверхні підвищений вміст важкої води характерно лише на низьких широтах.
Поблизу полюсів свої особливості. У високих південних широтах (в Антарктиці) океанські води помітно "легші". У цьому позначається вплив талих вод антарктичних айсбергів, які відрізняються найбільш низьким вмістом дейтерію на планеті.
Невелика частка дейтерію і в льодах Гренландії, тим не менш, океанські води високих північних широт збагачені важкою водою. Тут позначається танення "важких" арктичних льодів.
Власне важка вода D2O в природі знаходиться в незначних кількостях - в мільйонних частках відсотка. Переважає її різновид, склад якої можна виразити формулою HDO.
Важка вода - дуже важлива промислова сировина, ефективний сповільнювач швидких нейтронів. Тому вже зараз її широко застосовують у різних реакторних установках. А в майбутньому важка вода може стати сировиною для термоядерної енергетики: 1 г дейтерію при термоядерному розпаді дає в 10 млн. разів більше енергії, ніж 1 г вугілля при згорянні. У Світовому океані міститься 10^15 тонн HDO.
Відкриття останніх років показали, що важка вода відіграє чималу роль у біологічних процесах. Це й зрозуміло, адже вона є постійною і повсюдною домішкою природних вод. Систематичне вивчення її впливу на тварин і рослини розпочато порівняно недавно. Різні дослідники незалежно один від одного встановили, що важка вода діє негативно на життєві функції організмів; це відбувається навіть при використанні звичайної природної води з підвищеним вмістом важкої води .
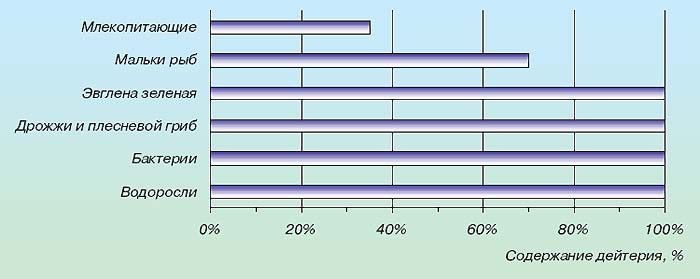 *Виживаність організмів у воді, що містить дейтерій .
Піддослідних тварин напували водою, 1/3 частина якої була замінена водою складу HDO. Через недовгий час починалося розлад обміну речовин тварин, руйнувалися нирки. При збільшенні частки важкої води тварини гинули.
На розвиток вищих рослин важка вода також діє гнітюче; якщо їх поливати водою, на половину складається з важкої води, ріст припиняється .

*Вплив концентрації дейтерію на ріст вищих рослин
Знижений вміст дейтерію у воді стимулює життєві процеси. Такі дані отримали Б.І. Родимов і І.П. Торопов. Вони довгий час спостерігали за рослинами і тваринами, які споживають воду, в якій містилося дейтерію на 25% нижче норми. Виявилося, що, споживаючи таку воду, свині, пацюки та миші дали потомство, набагато більш численною і крупніше звичайного, несучість курей піднялася вдвічі, пшениця дозріла раніше і дала більш високий урожай. Перші результати вивчення важкої води показують, скільки незвичайних властивостей таїть таке звичайне речовина, як вода. Відкриття важкої води послужило поштовхом до з'ясування фракційного складу води. Незабаром була виявлена надважка вода T2O. У її складі місце водню займає його природний ізотоп, ще більш важкий, ніж дейтерій. Це тритій (T), він радіоактивний, атомна маса його дорівнює 3. Тритій зароджується у високих шарах атмосфери, де йдуть природні ядерні реакції. Він є одним з продуктів бомбардування атомів азоту нейтронами космічного випромінювання. Щохвилини на кожен квадратний сантиметр земної поверхні падають 8 ... 9 атомів тритію. У невеликих кількостях надважка (тритієва) вода потрапляє на Землю в складі опадів. У всій гідросфері одночасно налічується лише близько 20 кг T2O. Тритієва вода розподілена нерівномірно: в материкових водоймах її більше, ніж в океанах; в полярних океанських водах її більше, ніж в екваторіальних. За своїми властивостями надважка вода ще помітніше відрізняється від звичайної: кипить при 104 ° С, замерзає при 4 ... 9 ° С, має густину 1,33 г/см3. Надважку воду застосовують у термоядерних реакціях. Вона зручніше дейтерієвої, оскільки її краще визначати. Перелік ізотопів водню не кінчається тритієм. Штучно отримані і більш важкі ізотопи 4H і 5H, теж радіоактивні. Таким чином, можливе існування молекул води, в яких містяться будь який з п'яти водневих ізотопів в будь-якому поєднанні. Цим не вичерпується складність ізотопного складу води. Існують також ізотопи кисню. У періодичній системі хімічних елементів Д.І. Менделєєва значиться всім відомий кисень 16O. Існують ще два природних ізотопи кисню — 17O і 18O. У природних водах в середньому на кожні 10 тисяч атомів ізотопу 16O припадає 4 атома ізотопу 17O і 20 атомів ізотопу 18O. За фізичними властивостями важкокиснева вода менше відрізняється від звичайної, ніж важководнева. Отримують її в основному перегонкою природної води і використовують як джерело препаратів з міченим киснем. Існування п'яти водневих і дев'яти кисневих ізотопів говорить про те, що ізотопних різновидів води може бути 135. Найбільш поширені в природі 9 стійких різновидів води: Основну масу природної води - понад 99% - складає протиєва вода - 1H216O(знайома нам H2O). Важкокисневих вод набагато менше. І хоча вміст протиєвої води в природі значно перевершує вміст всіх інших разом узятих видів, чистої H2O в природних умовах не існує. У всьому світі таку воду можна відшукати лише в небагатьох спеціальних лабораторіях. Її отримують дуже складним шляхом і зберігають надзвичайно обережно. Ось яке непросте це "найпростіше з'єднання - вода. Надалі, кажучи про воду та називаючи її загальноприйняту формулу H2O, будемо мати на увазі, що склад води, навіть повністю звільнений від мінеральних і органічних домішок, складний і різноманітний. Аномалії фізичних і хімічних властивостей води. Завдяки поверхневому натягу та властивості до змочування, вода може підніматись у вузьких вертикальних каналах на висоту більшу ніж та, яка допускається силою тяжіння, тобто вода має властивість капілярності. Капілярність відіграє важливу роль у багатьох природних процесах, що відбуваються на Землі. Завдяки цьому вода змочує товщу грунту, що лежить значно вище дзеркала грунтових вод і надає кореням рослин розчини поживних речовин. Капілярністю обумовлюється рух крові і тканинних рідин в живих організмах. Найвищими виявляються у води саме ті характеристики, які повинні були б бути найнижчими: температури кипіння і замерзання, теплоти пароутворення та плавлення. Щоб випарувати воду, вже нагріту до 100 ° С, потребує вшестеро більше кількості теплоти, чим для нагріву цієї ж маси води на 80 ° С (від 20 до 100 ° С). Питома теплота плавлення льоду більш висока, ніж у багатьох речовин, вона еквівалентна витраті кількості теплоти при нагріванні 1 г води на 80 ° С (від 20 до 100 ° С). При замерзанні води відповідна кількість теплоти надходить у навколишнє середовище, при таненні льоду - поглинається. Тому крижані маси, на відміну від мас пароподібної води, є свого роду поглиначами тепла в середовищі з плюсовою температурою. Аномально високі значення питомої теплоти пароутворення води і питомої теплоти плавлення льоду використовуються людиною у виробничій діяльності. Знання природних особливостей цих фізичних характеристик іноді підказує сміливі й ефективні технічні рішення. Так, воду широко застосовують у виробництві як зручний та доступний охолоджувач в самих різноманітних технологічних процесах. Після використання воду можна повернути в природниу водойму і замінити свіжою порцією, а можна знову направити на виробництво, попередньо охолодивши в спеціальних пристроях - градирнях. На багатьох металургійних виробництвах Донбасу в якості охолоджувача використовують не холодну воду, а кип'яток. Охолодження йде за рахунок використання теплоти пароутворення - ефективність процесу підвищується в кілька разів, до того ж відпадає потреба в спорудженні громіздких градирень. Звичайно, кип'яток-охолоджувач використовують там, де потрібно охолодити об'єкти, нагріті вище 100 ° C. А ось приклад зовсім з іншої області людської діяльності - сільського господарства, садівництва. Коли пізньою весною раптові нічні заморозки загрожують квітучим плодовим деревам, досвідчені садівники знаходять вихід, здається абсолютно несподіваним: вони проводять дощування саду. Пелена найдрібніших водяних бризок огортає дерева, що замерзають. Крапельки води покривають пелюстки квітів. Перетворюючись на лід, вода надягає на квіти крижану шубу, віддаючи при цьому їм своє тепло (335 Дж від; 1 г замерзлої води). Широке застосування води в якості охолоджувача пояснюється не тільки і не стільки її доступністю і дешевизною. Справжню причину треба теж шукати в її фізичних особливостях. Виявляється, вода має ще одну чудову здатність - високу теплоємність. Поглинаючи величезну кількість теплоти, сама вода суттєво не нагрівається. Питома теплоємність води в п'ять разів вище, ніж у піску, і майже в десять разів вище, ніж у заліза. Здатність води накопичувати більші запаси теплової енергії дозволяє згладжувати різкі температурні коливання на земній поверхні в різні пори року і в різний час доби. Завдяки цьому вода є основним регулятором теплового режиму нашої планети. Цікаво, що теплоємність води аномальна не тільки за своїм значенням. Питома теплоємність різна при різних температурах, причому характер температурної зміни питомої теплоємності своєрідний: вона знижується по мірі збільшення температури в інтервалі від 0 до 37 ° С, а при подальшому збільшенні температури - зростає. Мінімальне значення питомої теплоємності води виявлено при температурі 36,79 ° С, а адже це нормальна температура людського тіла! Нормальна температура майже всіх теплокровних живих організмів також знаходиться поблизу цієї точки. Міцніше сталі Серед незвичайних властивостей води важко обійти увагою ще одну - її виключно високий поверхневий натяг 0,073 Н / м (при 20 ° С). З всіх рідин більш високий поверхневий натяг має тільки ртуть. Вона проявляється в тому, що вода постійно прагне стягнути, скоротити свою поверхню, хоча вона завжди приймає форму ємностіі, в якій знаходиться в даний момент. Вода лише здається безформною, розтікаючись по будь-якій поверхні. Сила поверхневого натягу змушує молекули її зовнішнього шару зчіплюватися, створюючи пружну зовнішню плівку. Властивості плівки також визначаються замкнутими і розімкненими водневими зв'язкамиі. Завдяки плівці деякі предмети, будучи важчими за воду, не занурюються у воду (наприклад, обережно покладена сталева голка). Багато комах (водомірки, ногохвостки та ін) не тільки пересуваються по поверхні води, але злітають з неї і сідають, як на тверду опору. Більш того, живі істоти пристосувалися використовувати навіть внутрішню сторону водної поверхні. Личинки комарів повисають на ній за допомогою незмочуваних щетинок, а маленькі равлики - прудовики і котушки - повзають по ній у пошуках здобичі. Високий поверхневий натяг дозволяє воді приймати кулясту форму при вільному падінні або в стані невагомості: така геометрична форма має мінімальну для даного об'єму поверхню. Струмінь хімічно чистої води перетином 1 см2 по міцності на розрив не поступається сталі того ж перетину. Водний струмінь як би цементує сила поверхневого натягу. Поведінка води в капілярах підкоряється і більш складним фізичним закономірностям. . Особливості структурування води в капілярних системах дозволяють з певною підставою говорити про капілярний стан води. У природних умовах цей стан можна спостерігати у так званій поровій воді. У вигляді найтоншої плівки вона вистилає поверхню порожнин, пір, тріщин порід і мінералів земної кори. Розвинені міжмолекулярні контакти з поверхнею твердих тіл, особливості структурної впорядкованості, ймовірно, і є причиною того, що порова вода замерзає при більш низькій температурі, ніж звичайна - вільна - вода. Дослідження показали, що при замерзанні зв'язаної води виявляються не тільки зміни її властивостей, - іншими стають і властивості тих гірських порід, з якими вона безпосередньо контактує. Дивацтва простого льоду Здавалося б, що може бути звичніше льоду. У середній смузі Євразії, де зима триває кілька місяців, на півночі, де зима триває більшу частину року, та й у південних гірських районах сніг і лід - звичні компоненти ландшафту. Тим часом незвичайний сам процес утворення льоду. Подивимося, наприклад, як змінюється об’єм води при переході з рідкого стану в твердий, тобто при замерзанні. Ця зміна відбувається зовсім не так, як у інших відомих нам речовин. Всі вони, крім вісмуту і галію, стискаються, скорочують об’єм по мірі охолодження. При затвердінні їх об’єм значно зменшується в порівнянні з такою ж масою розплаву. Їх густина у твердому стані відповідно стає вище, ніж у рідкому. При замерзанні води все відбувається навпаки - густина льоду зменшується, а об’єм збільшується на 10% у порівнянні з об’ємом, займаним тією ж масою води. 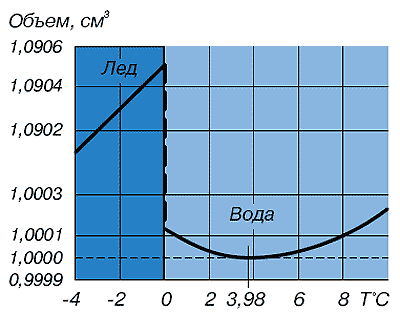 *Залежність відносного об'єму води від температури
Здавна люди знали цю властивість льоду.
Не вміючи його пояснити, вони, тим не менш, успішно ним користувалися.
Могутні споруди на півночі Європи зводилися з кам'яних монолітів, що важать сотні кілограмів. Щоб виготовити такі блоки, в скелях пробивали порівняно неглибокі пази або вибирали відповідні тріщини. Перед настанням зимових холодів їх заливали водою, і лід, який утворювався, виконував роль вибухівки. Так терпляче, рік за роком, люди дробили найміцніші скелі, отримували будівельний матеріал, використовуючи розширення води при замерзанні.
Тепер наука може пояснити причину цього явища.
Як видно з рис., зміна об’єму води з пониженням температури йде своєрідно. Спочатку вода веде себе, як і багато інших рідини: потроху ущільнюючи, зменшує свій об’єм. Це спостерігається аж до 4 ° С (точніше - до 3,98 ° С).
При цій температурі наче б настає криза. Подальше охолодження вже не зменшує, а поступово збільшує об’єм. Плавність різко переривається при 0 ° С, крива переходить в прямовисну пряму, об’єм стрибком зростає майже на 10%. Вода перетворюється на лід.
Завдяки особливості структурного переходу "вода - лід", в інтервалі 3,98 ... 0 ° С природні водойми достатньої глибини звичайно не промерзають до дна.
З настанням зимових холодів верхні шари води, охолоджуються приблизно до +4 ° С і досягнувши максимальної густиниі, опускаються на дно водойми. Ці шари несуть в глибини кисень і допомагають рівномірному розподілу поживних домішок. На їх місце до поверхні піднімаються більш теплі маси води, ущільнюються, остигаючи при контакті з приповерхневим повітрям, і, охолоджуються до +4 ° С, в свою чергу опускаються вглиб. Перемішування триває до тих пір, поки циркуляція не вичерпається і водойма не покриється плаваючим шаром льоду. Лід надійно охороняє глибини від суцільного промерзання - адже його теплопровідність набагато менше, ніж води.
Джерело: за матеріалами статті
Л. А. Кульский, В. В. Даль, Л. Г. Ленчина. „Вода знакомая и загадочная". © Издательство „Радянська школа", 1982
„Наука и техника"
|